การควบคุมคุณภาพข้าวเพื่อการส่งออกและความปลอดภัยของผู้บริโภค
ดร.นุชนาถุ รังคดิลก*, สุมลธา หนูคาบแก้ว, และ รศ.ดร.จุฑามาศ สัตยวิวัฒน์#
ห้องปฏิบัติการเภสัชวิทยา สถาบันวิจัยจุฬาภรณ์ (CRI)
#อาจารย์ประจำหลักสูตรพิษวิทยาสิ่งแวดล้อม สถาบันบัณฑิตศึกษาจุฬาภรณ์ (CGI)
ปัจจุบันนักวิทยาศาสตร์ให้ความสนใจเกี่ยวกับปัญหาสุขภาพอันเนื่องจากการได้รับอาหารที่เกิดจากการปนเปื้อนของสารเคมีในสิ่งแวดล้อม โดยเฉพาะสารหนู การตรวจวิเคราะห์หาปริมาณสารหนูในข้าวซึ่งเป็นอาหารหลักในการบริโภคสำหรับคนไทยจึงเป็นสิ่งจำเป็นอย่างยิ่ง ในการวิเคราะห์หาปริมาณสารหนู (Arsenic) ในตัวอย่างต่างๆนิยมใช้วิธี Graphite Furnace Atomic Absorption Spectrometry (GFAAS) ซึ่งหาปริมาณสารหนูในรูปสารหนูทั้งหมด (Total As) [1-3] แต่เนื่องจากความเป็นพิษของสารหนูขึ้นอยู่กับชนิดและรูปแบบ (species) ที่แตกต่างกันของสารหนูดังนั้นจึงมีการศึกษาหาปริมาณ species ของสารหนูโดยใช้วิธี Hydride Generation Atomic Absorption Spectrometry (HG-AAS) [4-7] ซึ่งเทคนิค HG-AAS เป็นเทคนิคที่ค่อนข้างยุ่งยาก ในปัจจุบันจึงมีเทคนิคที่นิยมกันมากคือ Inductively Coupled Plasma Mass Spectrometry (ICP-MS) ซึ่งเป็นเทคนิคที่สามารถวิเคราะห์หาปริมาณสารหนูรวมถึงโลหะหนักชนิดอื่นได้ด้วย เป็นเทคนิคที่มีความไววิเคราะห์สูง (sensitivity) และสามารถวิเคราะห์ได้หลายธาตุในครั้งเดียวกัน (Multielement analysis) [8,9] และเพื่อจำแนก species ของสารหนู จึงมีการนำเทคนิค High Performance Liquid Chromatography (HPLC) มาต่อเข้ากับเทคนิคที่ใช้ในการตรวจวัดสารหนูคือ HG-AAS [10,11] และที่นิยมมากคือต่อเข้ากับ ICP-MS [12-14]
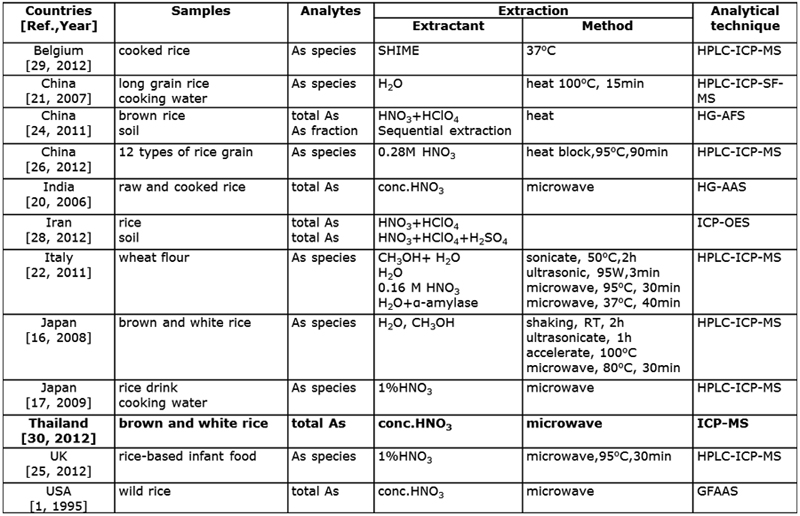
ในการทำวิจัยเกี่ยวกับสารหนูในข้าวเป็นที่น่าสนใจของหลายๆกลุ่มงานวิจัยทั่วโลก (ตารางที่ 1) และวิธีที่นิยมมากที่สุดคือ HPLC-ICP-MS [15-19] โดยศึกษาปัจจัยต่างๆที่มีผลต่อ สารหนูในข้าว เช่น ศึกษาปริมาณ Total As ในข้าวที่มาจากการหุงข้าวด้วยวิธีที่แตกต่างกัน [20,21] พบว่า ถ้าใช้น้ำล้างข้าวสารที่มีสารหนูสูง จะมีสารหนูในข้าวสุกสูงด้วย และการหุงข้าวด้วยวิธีต่างกันก็ทำให้ปริมาณสารหนูในข้าวต่างกันด้วย นอกจากนี้มีงานวิจัยที่ศึกษาวิธีการสกัดตัวอย่างข้าวเพื่อนำไปวิเคราะห์หา species ต่างๆ ของสารหนู พบว่าการสกัดด้วยตัวสกัดที่ต่างกัน (น้ำ กรดไนตริก เมทานอล และ เอนไซม์) [22] และวิธีสกัดที่ต่างกัน (shaking, heating, ultrasonic, accelerate และ microwave) [16] จะทำให้ผลการสกัดแตกต่างกัน (extraction efficiency) ซึ่งการสกัดที่ดีที่สุด คือ ใช้น้ำและสกัดด้วยไมโครเวฟ ที่อุณหภูมิ 80ºC [16] มีการศึกษาการเกิด interconversion ของสารหนูในระหว่างการสกัด [22] รวมถึงการสกัดด้วยวิธีเดียวกันแต่ใช้ข้าวต่างชนิดกันก็มีประสิทธิภาพการสกัดที่แตกต่างกัน [23] และมีงานวิจัยในประเทศต่างๆเกี่ยวกับการวิเคราะห์หาปริมาณสารหนูทั้งในแบบ Total As และ species โดยการสุ่มตัวอย่างข้าวต่างๆหรือผลิตภัณฑ์จากข้าว รวมถึงปริมาณสารหนูในส่วนต่างๆของข้าว [17,24-27] นอกจากนี้ยังมีการศึกษาเปรียบเทียบปริมาณ Total As ในข้าวเปรียบเทียบกับปริมาณ Total As ในดินที่ปลูก [28] พบว่า ไม่มีความสัมพันธ์เชิงเส้นตรงกัน และมีการศึกษา speciation ของสารหนูในดินโดยวิธี Sequential Extraction เพื่อดูความสัมพันธ์ของสารหนูในดินและในข้าว [24] พบว่า บาง fraction ของสารหนูในดิน มีความสัมพันธ์เชิงเส้นตรงกับสารหนูในข้าว (brown rice) นอกจากนี้ได้มีงานวิจัยที่ศึกษาเกี่ยวกับ Bioaccessibility ของสารหนูในข้าว โดยการสกัดข้าวด้วยการจำลองในระบบทางเดินอาหาร (3 stages คือ กระเพาะ ลำไส้เล็ก และลำไส้ใหญ่) โดยใช้ The simulator of the human intestinal microbial ecosystem (SHIME) [29] ผลการศึกษา พบว่า Bioaccessibility ของสารหนูทั้ง 3 stages คือ 38-43%
ในปัจจุบันหลายประเทศให้ความสำคัญกับการปนเปื้อนสารหนูในข้าว ซึ่งไม่ได้จำเพาะแต่ Total As เท่านั้น แต่จำเป็นต้องทราบค่าสารหนูแต่ละ species ด้วย โดยเฉพาะสารหนูอนินทรีย์ ซึ่งมีความเป็นพิษสูง คณะกรรมการโคเด็กซ์สาขาสารปนเปื้อน (Codex Committee on Contaminants in Foods) จัดตั้งขึ้นโดยองค์การอาหารและเกษตรแห่งสหประชาชาติ (FAO) และองค์การอนามัยโลก (WHO) ซึ่งทำหน้าที่กำหนดมาตรฐานอาหาร (Codex Standard) ได้มีความพยายามที่จะกำหนดค่าปริมาณปนเปื้อนสูงสุด (Maximum Level; ML) ของสารหนูอนินทรีย์ในข้าว รวมถึงหาวิธีมาตรฐานที่จะใช้ในการวิเคราะห์ด้วย ซึ่งจะมีการประชุมกันที่ประเทศจีน ในเดือนมีนาคม 2555
ทางสถาบันวิจัยจุฬาภรณ์ ได้ทำการศึกษาหาปริมาณสารหนู (Total As) ในข้าวและผลิตภัณฑ์จากข้าว โดยการเก็บตัวอย่างมาตั้งแต่ปี 2550 [30] และกำลังอยู่ระหว่างการวิจัยที่จะศึกษา As speciation ในข้าว โดยใช้เทคนิค HPLC-ICP-MS ซึ่งเป็นเทคนิคที่ให้ความถูกต้องแม่นยำสูง ข้อมูลที่ได้จากการศึกษา speciation จะเป็นข้อมูลที่เป็นประโยชน์ สามารถนำมาใช้ในการอ้างอิงคุณภาพและการติดตามแนวโน้มการปนเปื้อนของสารหนู เพื่อหาสาเหตุและป้องกันการปนเปื้อนในข้าว นอกจากนี้ยังเป็นการควบคุมและรักษามาตรฐานคุณภาพของข้าวไทยให้ปลอดภัยจากการปนเปื้อนของสารหนู เพื่อความปลอดภัยของผู้บริโภคข้าวในประเทศ และเพื่อรักษาตลาดการส่งออกข้าวไทยซึ่งเป็นที่ยอมรับกันว่าเป็นข้าวที่มีคุณภาพสูง
ตารางที่ 1: สรุปงานวิจัยเกี่ยวกับสารหนูในข้าวจากประเทศต่างๆ
เอกสารอ้างอิง
- Nriagu, J.O., Lin, T.S., 1995. Trace metals in wild rice sold in the United States. The Sci.Tolal Environ. 172, 223-228.
- Pergantis, S.A., Cullen, W.R., Wade, A.P., 1994. Simplex optimization of conditions for the determination of arsenic in environmental samples by using electrothermal atomic absorption spectrometry. Talanta 41(2), 205-509.
- Campillo, N., Viñas, P., López-García, I., Hernández-Córdoba, M., 2000. Determination of arsenic in biological fluids by electrothermal atomic absorption spectrometry. Analyst 125, 313–316.
- Coelho, N.M.M., Cósmen da Silva, A., Moraes da Silva, C., 2002. Determination of As(III) and total inorganic arsenic by flow injection hydride generation atomic absorption spectrometry. Anal. Chim. Acta 460, 227–233.
- Ng, J.C., Johnson, D., Imray, P., Chiswell, B., Moore, M.R., 1998. Speciation of arsenic metabolites in the urine of occupational workers and experimental rats using an optimized hydride cold-trapping method. Analyst 123, 929–933.
- Howard, A.G., Salou, C., 1998. Arsenic speciation by cryogenic trap hydride generation atomic absorption spectroscopy: performance enhancement by pre-derivatization. J. Anal. At. Spectrom. 13, 683–686.
- Shraim, A., Chiswell, B., Olszowy, H., 1999. Speciation of arsenic by hydride generation-atomic absorption spectrometry (HG-AAS) in hydrochloric acid reaction medium. Talanta 50, 1109-1127.
- Chen, K.L., Amarasiriwardena, C. J., Christian, D.C., 1999. Determination of total arsenic aoncentrations in nails by inductively coupled plasma mass spectrometry. Biol. Trace Elem. Res. 67, 109-125.
- Nookabkaew, S., Rangkadilok, N., Satayavivad, J., 2006. Determination of trace elements in herbal tea products and their infusions consumed in Thailand. J. Agri. Food Chem. 54, 6939-6944.
- Gómez-Ariza, J.L., Sánchez-Rodas, D., Giráldez, I., 1998. Selective extraction of iron oxide associated arsenic species from sediments for speciation with coupled HPLC-HG-AAS. J. Anal. At. Spectrom. 13, 1375–1379.
- Tsalev, D.L., Sperling, M., Welz, B., 1998. Speciation determination of arsenic in urine by high-performance liquid chromatography–hydride generation atomic absorption spectrometry with on-line ultraviolet photo oxidation. Analyst 123, 1703–1710.
- Yoshinaga, J., Chatterjee, A., Shibata, Y., Morita M., Edmonds, J.S., 2000. Human urine certified reference material for arsenic speciation. Clinic. Chem. 46(11), 1781–1786.
- Raml, R., Goessler, W., Francesconi, K.A., 2006. Improved chromatographic separation of thio-arsenic compounds by reversed-phase high performance liquid chromatography-inductively coupled plasma mass spectrometry. J. Chromatogr. A 1128, 164–170.
- Wang, P., Zhao, G., Tian, J., SU, X., 2010. High-performance liquid chromatography-inductively coupled plasma mass spectrometry based method for the determination of organic arsenic feed additives and speciation of anionic arsenics in animal Feed. J. Agric. Food Chem. 58, 5263–5270.
- Baba, K., Arao, T., Maejima, Y., Watanabe, E., Eun, H., Ishizak, M., 2008. Arsenic speciation in rice and soil containing related compounds of chemical warfare agents. Anal. Chem. 80, 5768–5775.
- Narukawa, T., Inagaki, K., Kuroiwa, T., Chiba, K., 2008. The extraction and speciation of arsenic in rice flour by HPLC–ICP-MS. Talanta 77, 427–432.
- Signes-Pastor, A.J., Deacon, C., Jenkins, R.O., Haris, P.I., Carbonell-Barrachina, A.A., Meharg, A.A., 2009. Arsenic speciation in Japanese rice drinks and condiments. J. Environ. Monit. 11, 1930–1934.
- Huang, J.H., Ilgen, G., Fecher, P., 2010. Quantitative chemical extraction for arsenic speciation in rice grains. J. Anal. At. Spectrom. 25, 800–802.
- Arao, T., Kawasaki, A., Baba, K., Matsumoto, S., 2011. Effects of arsenic compound amendment on arsenic speciation in rice grain. Environ. Sci. Technol. 45, 1291–1297.
- Sengupta, M.K., Hossain, M.A., Mukherjee, A., Ahamed, S., Das, B., Nayak, B., Pal, A., Chakraborti, D., 2006. Arsenic burden of cooked rice: Traditional and modern methods. Food Chem. Toxicol. 44, 1823–1829.
- Mihucz, V.G., Tatar, E., Virag, I., Zang, C., Jao, Y., Zaray, G., 2007. Arsenic removal from rice by washing and cooking with water. Food Chem. 105, 1718–1725.
- D’Amato, M., Aureli, F., Ciardullo, S., Raggi, A., Cubadda, F., 2011. Arsenic speciation in wheat and wheat products using ultrasound- and microwave-assisted extraction and anion exchange chromatography-inductively coupled plasma mass spectrometry. J. Anal. At. Spectrom, 26, 207-213.
- Narukawa, T., Hioki, A., Chiba, K., 2012. Speciation and monitoring test for inorganic arsenic in white rice flour. J. Agric. Food Chem. 60, 1122-1127.
- Fu, Y., Chen, M., Bi, X., He, Y., Ren, L., Xiang, W., Qiao, S., Yan, S., Li, Z., Ma, Z., 2011. Occurrence of arsenic in brown rice and its relationship to soil properties from Hainan Island, China. Environ. Pollut. 159, 1757-1762.
- Carbonell-Barrachina, A.A., Wu, X., Ramírez-Gandolfo, A., Norton, G.J., Burló, F., Deacon, C., Meharg, A.A., 2012. Inorganic arsenic contents in rice-based infant foods from Spain, UK, China and USA. Environ. Pollut. 163, 77-83.
- Huang, J.H., Fecher, P., Ilgen, G., Hud, K.N., Yang, J., 2012. Speciation of arsenite and arsenate in rice grain – Verification of nitric acid based extraction method and mass sample survey. Food Chem. 130, 453–459.
- Ye, X.X., Sun, B., Yin, Y.L., 2012. Variation of As concentration between soil types and rice genotypes and the selection of cultivars for reducing As in the diet. Chemosphere (in press).
- Rezaitabar, S., Esmaili-Sari, A., Bahramifar, N., 2012. Potential health risk of total arsenic from consumption of farm rice (Oryza sativa) from the Southern Caspian Sea Littoral and from imported rice in Iran. Bull. Environ. Contam. Toxicol. Published online:10 Feb 2012.
- Sun, G.X., Van de Wiele, T., Alava, P., Tack, F., Laing, G.D., 2012. Arsenic in cooked rice: Effect of chemical, enzymatic and microbial processes on bioaccessibility and speciation in the human gastrointestinal tract. Environ. Pollut. 162, 241-246.
- Rangkadilok, N., Nookabkaew, S., Satayavivad, J., 2012. ความปลอดภัยในการบริโภคอาหารเช้า. Retrieved from http://www.etm.sc.mahidol.ac.th/a22.shtml
เผยแพร่ ณ วันที่ 11 มิถุนายน 2555